Biografia de Amedeo Avogadro | Cientistas famosos.

Nota: Esta tradução é fornecida para finalidades educacionais e podem conter erros ou ser imprecisa.
Viveu 1776-1856.
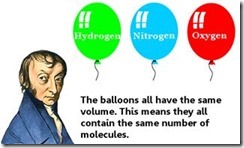
Amedeo Avogadro é mais conhecido por sua hipótese que volumes iguais de gases diferentes contêm um número igual de moléculas, desde que estejam na mesma temperatura e pressão.
Sua hipótese foi rejeitada por outros cientistas. Só ganhou aceitação após a sua morte. Agora chama-se lei de Avogadro.
Ele também foi o primeiro cientista a perceber que elementos podem existir sob a forma de moléculas, em vez de átomos individuais.
Vida de Avogadro
Amedeo Avogadro nasceu em Turim, na Itália, em 9 de agosto de 1776.Sua família era aristocrática. Seu pai, Filippo, foi um magistrado e senador que tinha o título de Conde. Sua mãe era uma nobre, Anna Vercellone de Biella.
Amedeo Avogadro herdou o título de Conde de seu pai. Na verdade, o nome completo de Amedeo Avogadro foi conde Lorenzo Romano Amedeo Carlo Avogadro di Quaregna e di Cerreto – uma história e tanto!
Avogadro foi altamente inteligente. Em 1796, quando ele tinha apenas 20, ele recebeu um doutorado em direito canônico e começou a prática como um advogado eclesiástico.
Embora ele tinha seguido a tradição familiar de estudar direito, ele gradualmente perdeu o interesse em assuntos legais. Ele achou que a ciência era muito mais intelectualmente estimulante.
Matemática e física em particular atraiu sua mente lógica. Ele passou de quantidades crescentes de tempo a estudar estes assuntos. Ele foi ajudado pelo físico matemático proeminente Professor Vassalli Eandi.
Em 1803, em colaboração com seu irmão Felice, Avogadro publicou seu primeiro trabalho científico, que analisou o comportamento elétrico de soluções salinas. Este foi o estado-da-arte ciência: apenas três anos antes, o colega cientista italiano Avogadro, Alessandro Volta tinha demonstrado a bateria elétrica pela primeira vez.
Em 1806, com idades entre 30, Avogadro abandonou sua bem sucedida prática jurídica e começou a dar aulas de matemática e física em uma escola em Turim. Em 1809, ele se tornou professor sênior da faculdade de Vercelli.
Em 1820 Avogadro tornou-se professor de física matemática na Universidade de Turim. Infelizmente, este post durou pouco, por causa da turbulência política. Avogadro perdeu o emprego em 1823.
Avogadro foi reconduzido em 1833 e permaneceu neste post até que, na idade de 74, aposentou-se em 1850.
Embora ele era um aristocrata, Avogadro foi um homem-a-terra, privado, que estava em silêncio religioso. Ele era dedicado ao trabalho árduo e seu estilo de vida era simples. O nome da esposa era Felicita Mazzé. Eles se casaram em 1818 quando Avogadro tinha 42 anos. Eles tiveram seis filhos.
Contribuições Avogadro para a ciência
No início de 1800, idéias dos cientistas sobre as partículas que hoje chamamos de átomos e moléculas foram muito limitados e muitas vezes incorreta. Avogadro estava profundamente interessado em descobrir como as partículas fundamentais da matéria se comportou e se uniram para formar compostos químicos.Ele estudou o trabalho de dois outros cientistas:
1. John Dalton
Em 1808, John Dalton publicou sua teoria atômica, propondo que toda a matéria é feita de átomos. Além disso, ele afirmou que todos os átomos de um elemento são idênticos, e os átomos de elementos diferentes têm massas diferentes. Ao fazer isso, Dalton carregava química a um novo nível. Mas ele também cometeu erros sobre os elementos de forma se combinam para formar compostos. Por exemplo, ele pensou que água foi feita de um átomo de hidrogênio e um átomo de oxigênio e escreveu-a como HO; Hoje sabemos que a água contém dois hidrogênios para cada oxigênio e escrevemos água como H20. Na verdade, Avogadro imaginei isto, como veremos.2. Joseph Gay-Lussac
Em 1809, Joseph Gay-Lussac publicou sua lei da combinação de volumes de gás. Ele tinha notado que quando dois litros de gás hidrogênio reagem com um litro de gás oxigênio, formam dois litros de água gasosa. Todos os gases que ele reagiu pareciam reagir em rácios de volume simples.Hipótese de Avogadro
Em 1811 Avogadro publicou um artigo no Journal de Physique, o francês Journal of Physics. Ele disse que a melhor explicação para as observações de Gay-Lussac de reações de gás que volumes iguais de todos os gases com a mesma temperatura e pressão contêm números iguais de moléculas. Isto é chamado lei de Avogadro. Publicou-o quando ele estava trabalhando como professor de física na faculdade de Vercelli.De Avogadro (correto), a razão que dois litros de gás hidrogênio reagem com um litro de gás oxigênio para formar apenas dois litros de água gasosa é que o volume diminui porque o número de partículas presentes diminui. Portanto, deve ser a reação química:
2H2 (gás) + O2 (gás) → 2 H20 (gás)
Nesta reação três partículas (duas moléculas de hidrogênio e oxigênio de uma molécula) vem junto para dar forma a duas partículas de água... ou 200 partículas reagem com 100 partículas para formar 200 partículas... ou 2 milhões de partículas reagem com 1 milhão de partículas para formar partículas de 2 milhões... etc. O efeito observável é que após a reação, quando todos os gases hidrogênio e oxigênio se tornaram H20 gás, o volume de gás cai para dois terços do volume inicial.
Como resultado destas observações Avogadro tornou-se o primeiro cientista a perceber que os elementos podem existir como moléculas ao invés de átomos individuais. Por exemplo, ele reconheceu que o oxigênio ao nosso redor existe como uma molécula na qual dois átomos de oxigênio estão ligados.
Outros cientistas no campo, como Dalton, acredita-se que apenas compostos poderiam formar moléculas enquanto existiam de todos os elementos como átomos único.

Avogadro percebeu que elementos podem existir sob a forma de moléculas com átomos individuais juntados-se.
Em 1815 Avogadro publicou um papel adicional no Journal de Physique discutindo as massas dos átomos, seus compostos e suas densidades de gás.
Em 1821, agora escrever que o professor de física matemática na Universidade de Turim, ele publicou um papel ainda mais olhando para as massas dos átomos e as proporções em que se combinam.
Entre 1837 e 1841 Avogadro publicou quatro volumes pesados olhar detalhadamente em física da matéria.
Achados de Avogadro foram quase completamente ignorados até Stanislao Cannizarro apresentou na conferência de Karlsruhe em 1860, quatro anos após a morte de Avogadro. Esta conferência tinha sido chamada para resolver a confusão científica que existiam sobre átomos, moléculas e suas massas.
Mesmo depois de Cannizarro apresentou o seu trabalho, nem todos os cientistas concordaram com isso. Outra década passado – com continuou forte defesa do Cannizarro – antes de hipótese do Avogardo tornou-se mais amplamente aceito e tornou-se lei de Avogadro.
Hoje Avogadro é considerado como um dos fundadores da química atômico-molecular.
Por que a hipótese de Avogadro foi rejeitado por décadas?
Há várias razões por que o trabalho de Avogadro não foi aceita rapidamente:• Publicou seu trabalho no Journal de Physique, que não era um jornal muito bem ler.
• As teorias dos cientistas mais conhecidos da época, como John Dalton e Jöns Jacob Berzelius, discordaram com o trabalho de Avogadro.
• Itália – o país de Leonardo da Vinci e Galileu – já não era considerada um país onde a grande ciência foi feita. Percebendo isso, alguns anos antes, o compatriota Avogadro Alessandro Volta tinha viajado da Itália para fazer a mesmo e seu trabalho conhecido por cientistas em outros países. Avogadro ficou na Itália e não fez contato pessoal com cientistas estrangeiros para ajudar a colmatar o fosso como Volta tinha feito.
Mesmo que nós gostamos de pensar da ciência como um empreendimento nobre, onde a verdade rapidamente se tornará óbvia, isso não é sempre o caso. Os cientistas são apenas pessoas; Eles podem ser teimosos, assim como todos nós pode ser às vezes. Se você tem uma controversa nova teoria científica, e não é bem conhecidos, parece que o contato pessoal às vezes pode atingir tanto quanto um artigo científico – ou até mais.
A constante de Avogadro
Constante de Avogadro é um dos números mais importantes em química. Seu valor é 6.02214129 x 1023. Avogadro não calcular este número, mas sua existência decorre logicamente sua hipótese e trabalho.Constante de Avogadro é o número de partículas (átomos ou moléculas) em um mol de qualquer substância. Por exemplo, 12 gramas de carbono contêm 6.02214129 x 1023 átomos de carbono.
Constante de Avogadro é um número enorme. Se você pudesse salvar 1 milhão de dólares por segundo, levaria mais tempo do que o universo é acreditado para ter existido para salvar 6.02214129 x 1023 dólares; Tudo que vai para mostrar o que leva um monte de átomos tornar-se uma pequena quantidade de matéria!
"Meus estudos das ciências naturais, particularmente envolveram essa parte da física que olha para o mundo atômico: as propriedades das moléculas, as forças envolvidas em seus movimentos, a capacidade térmica de diferentes substâncias, expansão dos gases pelo calor e a densidade e pressão dos gases."
Amedeo Avogadro, 1776-1856